Diagnostische Marker im Stuhl und was sie bedeuten
Die Messung von Proteinen und Enzymen im Stuhl kann Aufschluss über lokale Entzündungen, den Zustand der Darmschleimhaut, die Verdauungsleistung und die Immunabwehr des Darms geben.
Marker für Entzündungen der Darmschleimhaut
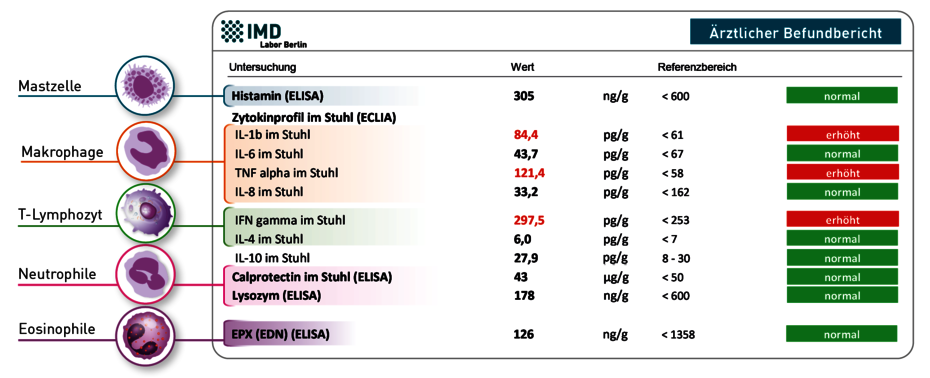
Zytokine spielen nicht nur in Blut und Gewebe, sondern auch in der Darmmukosa eine zentrale Rolle, da sie den komplexen Crosstalk zwischen Immunzellen, Epithelzellen und Bakterien regulieren. Die Messung von IL1-β, IL-6, IL-8, TNF-α und dem antientzündlichen Gegenspieler IL-10 im Stuhl zeigt nicht nur Entzündungsprozesse am sensitivsten an, sondern erlaubt auch die Untersuchung des „Immunstatus“ der Darmmukosa, was gezielte immunologische Therapien ermöglicht. Zudem stehen mit IFN-γ und IL-4 erstmals Marker zum Nachweis T-zellulärer Immunaktivierung (z.B. bei Virusinfektion, Typ IV-Allergien) zur Verfügung
Die Einwanderung von neutrophilen Granulozyten in die Darmmukosa lässt sich über Calprotectin nachweisen, ein Calcium- und Zink-bindendes Protein mit antimikrobiellen Eigenschaften. Erhöhte Werte im Stuhl sind ein Zeichen einer vermehrten Einwanderung von Granulozyten z.B. bei akuten Infektionen, proinflammatorischer Dysbiose, Divertikulitis, Neoplasien oder autoimmun bedingten entzündlichen Darmerkrankungen (z.B. Morbus Crohn, Colitis ulcerosa), nicht aber beim Reizdarm, allergisch oder viral bedingter Entzündung.
Lactoferrin ist ein eisenbindendes Protein, das, wie Calprotectin, von neutrophilen Granulozyten gebildet wird. Lactoferrin hat antimikrobielle und antioxidative Eigenschaften. Bei Säuglingen ist Lactoferrin allerdings kein geeigneter Entzündungsmarker, da es Bestandteil der Muttermilch ist
Lysozym ist ein antibakteriell wirkendes Enzym, das von Paneth-Zellen der Darmschleimhaut sezerniert sowie von Neutrophilen freigesetzt wird. Lysozym ist bei bakteriellen Infektionen, aber auch bei CED oft erhöht, besonders bei einer aktiven Entzündung der Dickdarmschleimhaut.
Erhöhte Werte für Calprotectin, Lactoferrin oder Lysozym weisen auf eine Infiltration von Neutrophilen in die Darmmukosa hin. Eine fehlende Erhöhung trotz vorhandener Entzündung (auffälliges Zytokinprofil!) kann dagegen als Indiz einer gestörten Immunabwehr interpretiert werden.
Eosinophiles Protein X (EPX oder EDN für Eosinophil Derived Neurotoxin) wird von eosinophilen Granulozyten gebildet, die v.a. an der Abwehr von Parasiten (v.a. Würmern) und an Typ I-allergischen Reaktionen beteiligt sind. Bei Nahrungsmittelallergien vom Typ I, aber auch bei Parasitenbefall werden erhöhte EPX-Werte im Stuhl gemessen. Bei Typ IV-Allergien steigt EPX dagegen nicht an.
Marker der intestinalen Immunhomöostase
Die wichtigste Aufgabe des intestinalen Immunsystems ist die „Moderation“ des komplexen Zusammenspiels von pathogenen und kommensalen Darmbakterien, ohne dass dabei Entzündung resultiert (Aufrechterhaltung der Wirts-Mikrobiota-Homöostase).
Ein dafür wichtiges Molekül ist das dimere (sekretorische) Immunglobulin A (sIgA). Zellständiges sIgA formiert auf den Darmepithelien eine Art Barriere und bietet Schutz gegen immunogene Bakterien und Toxine. Zudem kann in das Darmlumen abgegebenes sIgA mit Bakterien Immunkomplexe bilden und damit ihre Ausscheidung fördern.
Eine weitere wichtige Komponente der Erregerhomöostase sind antimikrobielle Peptide, die von Darmepithelzellen sezerniert werden. Dazu gehört β-Defensin 2. Die Expression von β-Defensin 2 wird durch Bakterien, Parasiten und Enterotoxine sowie durch einige proentzündliche Zytokine induziert.
Die Interpretation von sIgA und β-Defensin 2-Messwerten im Stuhl ist abhängig vom Entzündungszustand. Bei gesunder Schleimhaut und fehlender Dysbiose sollten sie weder erhöht noch vermindert sein. Bei Dysbiose oder granulozytär bedingter Entzündung sind sie als Ausdruck einer intakten Immunabwehr erhöht zu erwarten. Bleibt der Anstieg trotz Entzündungen oder Dysbiose aus, weist das auf eine reduzierte Immunabwehrkapazität der Darmepithelien hin. Zu beachten ist, dass 2 % der Bevölkerung einen selektiven IgA-Mangel haben, bei denen ein vermindertes sIgA im Stuhl regelhaft nachweisbar ist.
Marker für die Integrität der Darmschleimhaut
Die Stabilität der Zell-Zell-Verbindungen der Darmschleimhaut (tight junctions) wird über proinflammatorische Zytokine (IL-1β, TNF-α) und über Zonulin-Peptide reguliert.
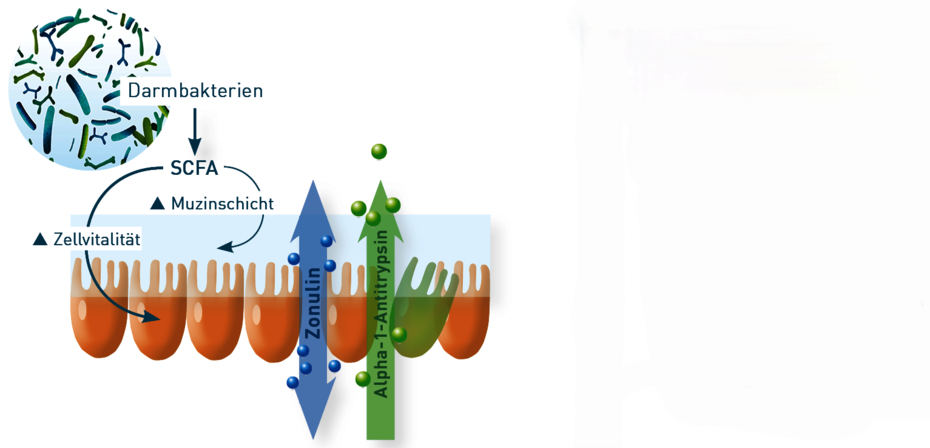
Zonulin öffnet reversibel interzelluläre tight junctions. Die Ausschüttung von Zonulin wird durch pathogene Bakterien, aber auch einige Nahrungsmittelantigene, insbesondere Weizenbestandteile, sowie proentzündliche Zytokine induziert. Dauerhaft erhöhte Werte weisen auf eine Permeabilitätsstörung der Darmmukosa (leaky gut) hin.
Ein anderer Marker zum Nachweis einer erhöhten intestinalen Permeabilität ist das Alpha-1-Antitrypsin. Weil es sich um ein sehr großes Molekular handelt, geht es nur bei erhöhter Schleimhautpermeabilität passiv in den Stuhl über. Erhöhte Werte kommen bei entzündlich und nicht entzündlich bedingtem leaky gut vor.
Kurzkettige Fettsäuren (SCFAs) wie Acetat, Butyrat und Propionat sind nicht nur wichtige Signalmoleküle der Darm-Hirn-Achse, sondern spielen auch eine Rolle bei der Aufrechterhaltung der Barrierefunktion und der Immunhomöostase des Darmes. V.a. Butyrat ist für die Energiebildung in Darmzellen essentiell und beeinflusst damit maßgeblich die Darmepithelfunktion (Barriere, Nährstoffaufnahme, Sekretion antimikrobieller Peptide u.a.). SCFAs induzieren außerdem die Schleimbildung zum Erhalt der Muzinschicht, die als mechanische Abwehrzone die Epithelzellen vor dem Kontakt mit Entzündungsauslösern schützt. Sie sollten deshalb zur Beurteilung der Integrität der Darmbarriere immer im Stuhl mitbestimmt werden.
Im Blut stehen neben Zonulin mit I-FABP und dem LPS-bindenden Protein (LBP) zwei weitere Marker zum Nachweis eines leaky gut zur Verfügung. Diese beiden Marker sind aber im Stuhl nicht bestimmbar. I-FABP wird zwar wie Zonulin auch in das Darmlumen (Stuhl) abgegeben, ist aber zu instabil für die Darmpassage. LBP wird in der Leber als Reaktion auf bakterielles Endotoxin (v.a. LPS), das bei leaky gut ins Blut übertritt, vermehrt gebildet.
Marker für die Verdauungsleistung
Die Pankreaselastase ist der Stuhlmarker zur Beurteilung der exokrinen Pankreasinsuffizienz. Es handelt sich um ein Pankreasenzym, das im Gegensatz zu anderen Pankreasenzymen während der Darmpassage nicht abgebaut wird. Studien haben gezeigt, dass die Messung dieses Enzyms gut mit der Produktion von Amylase, Lipase und Trypsin korreliert.
Die Messung von Verdauungsrückständen, also unverdauter Fette, Eiweiße und Zucker kann Störungen der Fett-, Protein- und Kohlehydratverdauung aufzeigen.
Gallensäuren sind für die Fettverdauung im Dünndarm essenziell. Sie emulgieren Nahrungsfette und machen sie so für Lipasen zugänglich. Sie werden im enterohepatischen Kreislauf zu ca. 95 % im terminalen Ileum rückresorbiert und zur Leber transportiert. Erhöhte Werte im Stuhl können ein Hinweis auf eine gestörte Rückresorption (Gallensäureverlustsyndrom sein. Das kann Diarrhoe und Schleimhautreizungen sowie eine schlechtere Fettverdauung zur Folge haben. Auch ein verminderter Wert für Gallensäuren im Stuhl kann auf eine Beeinträchtigung der Fettverdauung hinweisen. Bei den betroffenen Patienten werden auch fettlösliche Vitamine schlecht resorbiert.
Material
Wir benötigen unabhängig davon, wie viele der biochemischen Marker analysiert werden, zwei zu je 2/3 befüllte Stuhlröhrchen.
Um lagerungsbedingte Veränderungen zu vermeiden, muss der Transport der Stuhlröhrchen ins Labor temperaturstabilisiert innerhalb von maximal 48 h per Kurier erfolgen. Bitte ordern Sie unseren kostenfreien Kurier unter Tel. +49 30 77001-450.
Abrechnung
Eine Abrechnung ist bei gegebener Indikation für die Marker Alpha-1-Antitrypsin, Calprotectin, Lactoferrin, Lysozym, sIgA, Gallensäuren und Pankreaselastase im kassen- und privatärztlichen Bereich gegeben.
Die Abrechnung des Zytokinprofils und von β-Defensin, EPX, kurzkettigen Fettsäuren, Verdauungsrückständen und Zonulin ist nur im privatärztlichen Bereich (GOÄ) gegeben. Selbstzahler entnehmen die Kosten für die einzelnen Analysen bitte dem Anforderungsschein Mikrobiom Selbstzahler.
Literatur
- Farrugia, Alexia, and Ramesh Arasaradnam. „Bile acid diarrhoea: pathophysiology, diagnosis and management.“ Frontline Gastroenterology 12.6 (2021): 500-507.
- Fasano, Alessio. „Intestinal permeability and its regulation by zonulin: diagnostic and therapeutic implications.“ Clinical Gastroenterology and Hepatology 10.10 (2012).
- Gacesa, R., et al. „A combination of fecal calprotectin and human betadefensin 2 facilitates diagnosis and monitoring of inflammatory bowel disease.“ Gut Microbes 13.1 (2021): 1943288.
- Ganz, T. „Lysozyme.“ (2006): 649-653.
- Kovalszki, Anna, and Peter F. Weller. „Eosinophils and eosinophilia.“ Clinical immunology. Elsevier, 2019. 349-361.
- Rogier, Eric W., et al. „Secretory IgA is concentrated in the outer layer of colonic mucus along with gut bacteria.“ Pathogens 3.2 (2014).
- Siddiqui, Imran, Hafsa Majid, and Shahab Abid. „Update on clinical and research applica-tion of fecal biomarkers for gastrointestinal diseases.“ World journal of gastrointestinal pharmacology and therapeutics 8.1 (2017): 39.
- Vernia, Filippo, et al. „Is fecal calprotectin an accurate marker in the management of Crohn‘s disease?.“ Journal of gastroenterology and hepatology 35.3 (2020).